RSV药物及疫苗药效评价解决方案
呼吸道合胞病毒(Respiratory Syncytial Virus,RSV)是一种包膜单股负链RNA病毒, RSV可以引起全年龄段人群的呼吸道感染,是世界范围内引起5岁以下儿童急性下呼吸道感染(ALRTI)最常见的病毒病原,是造成婴幼儿病毒性呼吸道感染住院的首要因素。目前对于RSV的防治手段主要是疫苗及抗体药物,然而,疫苗方面国内目前尚未有一款产品获得批准上市。药物方面的研发热点集中在抗体药物的研发,如RSV融合抑制剂等。未来十年,中国RSV药物整体市场(包括治疗药物及预防药物)预计将增至2032年的57.95亿人民币,年复合增长率为70.7%。
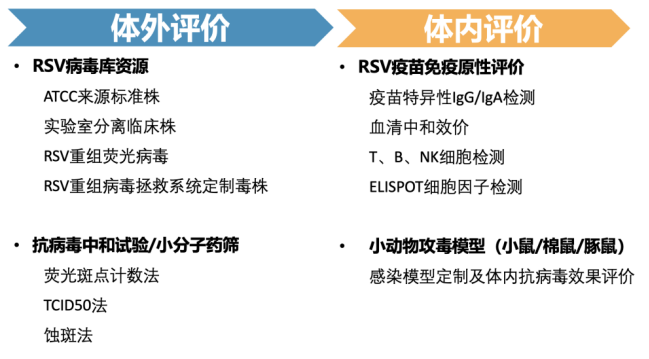
图1. RSV药效评价一体化解决方案
为助力更多RSV药物及疫苗的研发上市,迪福润丝生物专注于提供高质量的临床前研究支持,能够为客户提供从体外到体内的RSV药效评价一体化解决方案(图1)。在体外评价方面,我们运用荧光斑点计数法通过DIFF-GFP荧光报告病毒检测标记病毒抗原的荧光抗体,可以识别早期感染和低水平的病毒复制,24小时即可得到结果(图2),无需担心病毒大量复制引起细胞病变或合胞体对试验结果的影响,精准评估候选药物的抗病毒活性;在体内评价方面,我们基于多种动物模型,结合病毒载量检测、组织病理分析和炎症因子监测等手段,全面验证药物或疫苗的有效性。通过一体化的研究流程,迪福润丝生物能够高效衔接各阶段实验,帮助客户降低研发风险,加速产品推进,为抗RSV药物和疫苗的开发提供有力支持。

图2.荧光斑点计数法-RSV中和抗体检测的实验结果案例(左上角为荧光数值)
DIFF RSV毒株库
迪福润丝生物建立了完善的生物资源库(Bio Database),可提供丰富的RSV毒株进行更加准确可靠的疫苗评价。检测用毒株包括RSV A和RSV B两种亚型共9种毒株(图7),其中包括标准株、临床株(RSV-B 9393及2444)及重组病毒株等,有助于准确了解药物及疫苗对自然感染的有效性。
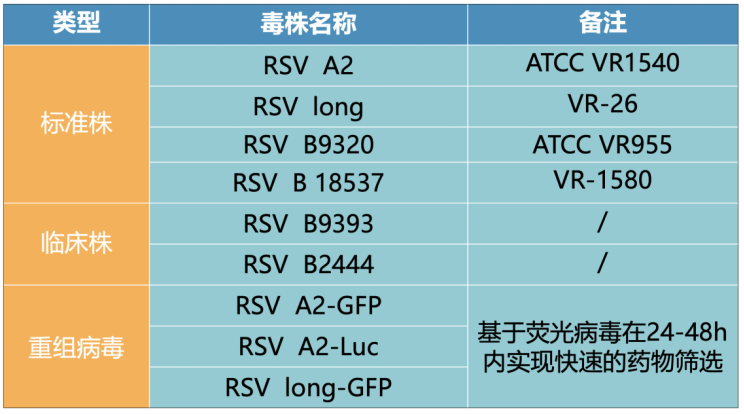
图7.迪福润丝生物RSV毒株库
RSV体内药效评价小动物模型
在动物模型的选择上,常用的包括小鼠、棉鼠、雪貂等。小鼠和棉鼠模型因其可操作性和对RSV的敏感性,广泛用于初步药效筛选(图3)。迪福润丝生物通过病毒接种的方式模拟小鼠、棉鼠的自然感染路径。
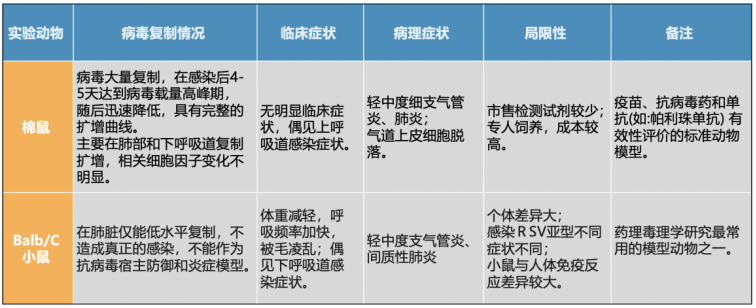
图3.RSV啮齿动物感染模型效果对比(棉鼠、Balb/C小鼠)
RSV攻毒保护试验案例
迪福润丝生物建立了针对棉鼠、Balb/C小鼠的感染模型。在下面的案例中,我们采用RSV A型和B型两种不同毒株对Balb/C小鼠进行攻毒,攻毒后收集收集小鼠的鼻、肺组织,通过qRT-PCR检测组织病毒载量,对某候选药物有效性进行评估(组图4、5)。
RSV-A2株攻毒结果如下:
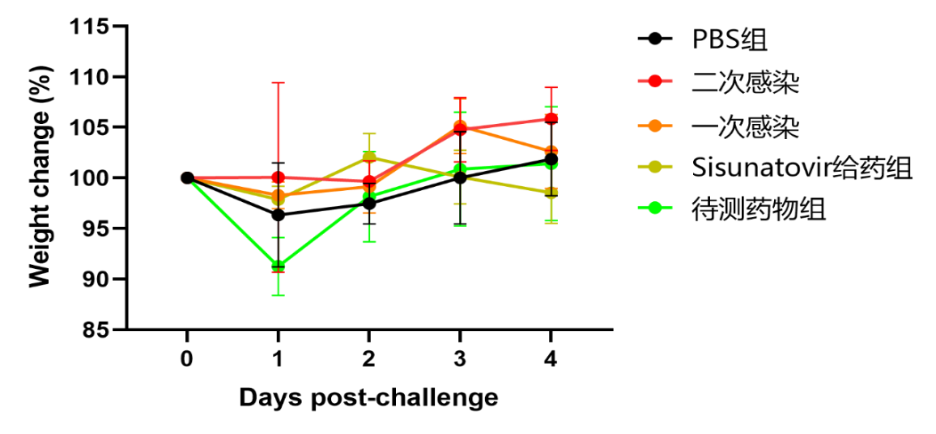
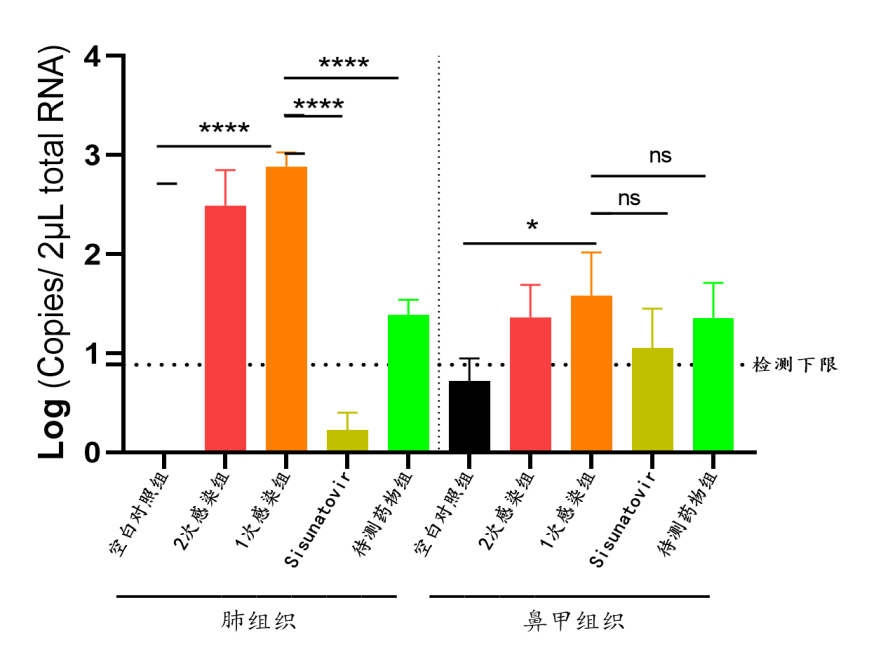
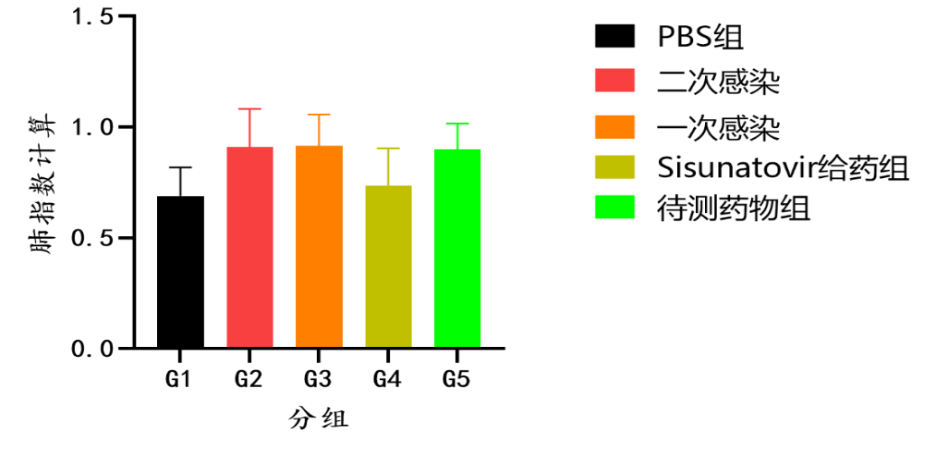
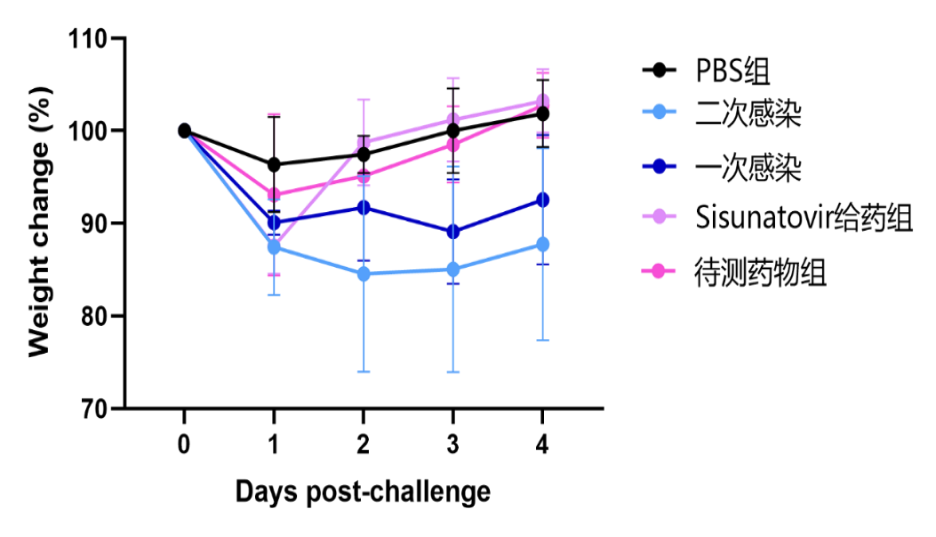
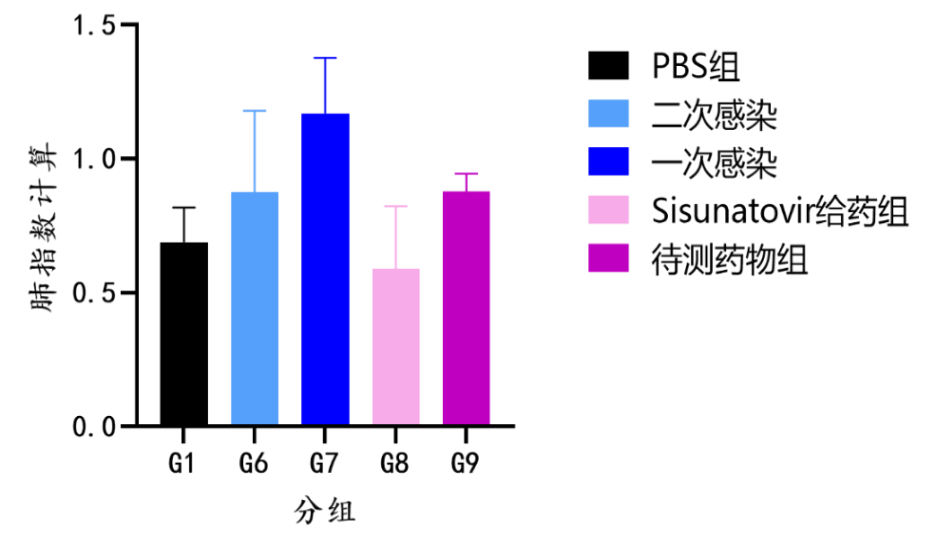
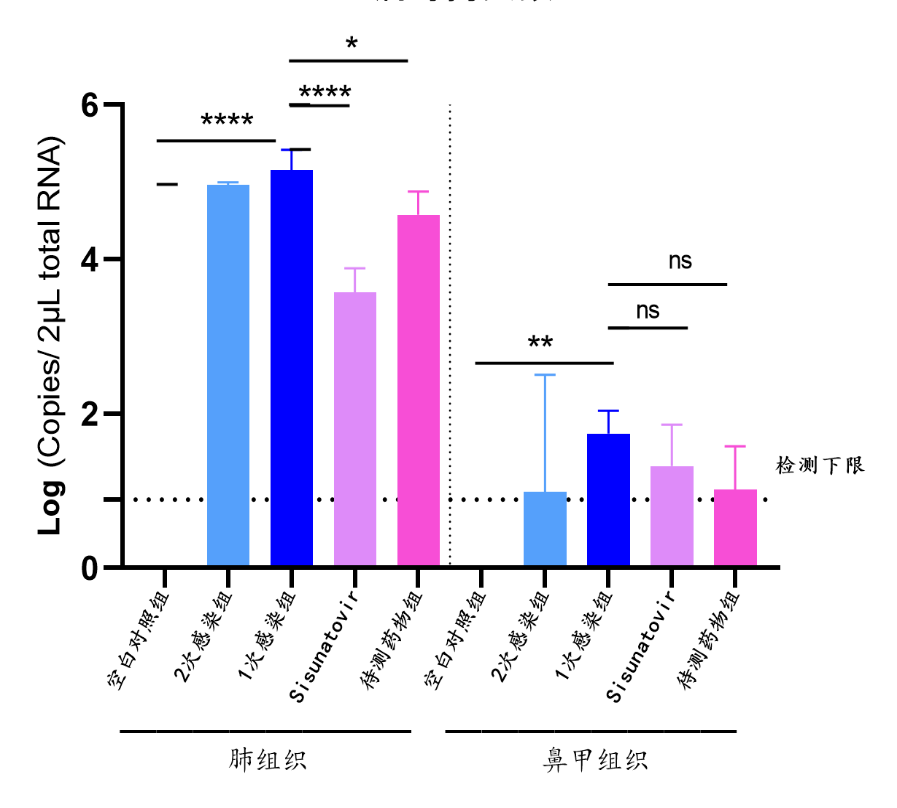
组图4.RSV-A2株攻毒试验结果(体重变化、肺指数、病毒拷贝数)
RSV-B9320株攻毒结果如下:
组图5.RSV-B9320株攻毒试验结果(体重变化、肺指数、病毒拷贝数)
RSV感染棉鼠并不会产生如体重、体温等临床体征的变化,但在肺部及棉鼠的下呼吸道有明显扩增变化。肺组织病毒基因和活病毒数目都在感染后第4-5天达到峰值,基因拷贝数可达10^6-7,活病毒数目达10^5-6。感染后第6-7天病毒滴度迅速下降。第7天病毒从肺部清除。病毒在鼻子中的复制时间略有延长,到第9天清除。血清NA在感染后第6-9天升高(图6)1。
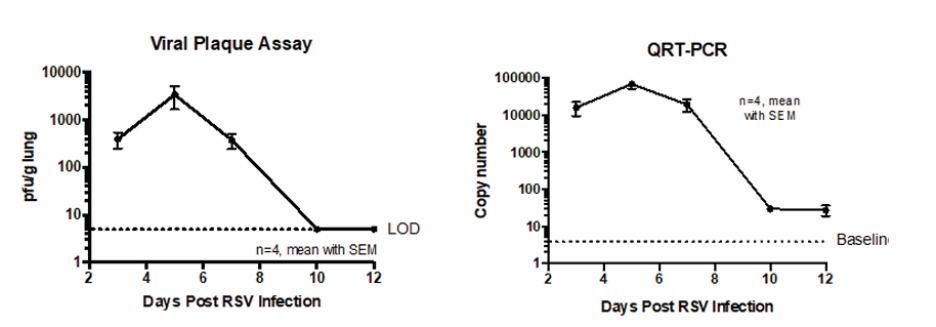
图6.RSV感染棉鼠模型后的感染情况
RSV体内药效评价服务内容
|
迪福润丝生物RSV体内药效评价服务 |
|
|
实验动物 |
棉鼠、Balb/C小鼠等 |
|
感染方式 |
吸入麻醉后滴鼻感染或气管攻毒 |
|
检测指标 |
• 鼻、肺组织病毒载量:定量PCR法、蚀斑法、TCID50法(抗病毒效果) • 血清结合/中和效价:特异性抗RSV IgG检测、不同毒株的微量中和实验(体液免疫效果) • 肺组织病理:肺组织HE染色,肺泡灌洗液流式检测炎性(评估疫苗增强效应的重要指标:肺泡炎) • 免疫细胞激活情况:流式细胞术(细胞免疫) • 细胞因子分泌情况:ELISPOT(细胞免疫)
|
|
成果交付 |
原始数据、检测报告等 |
参考文献
1. Xiang, Wen,Shi, Mo,Shenglin, Chen et al. Pathogenic difference of respiratory syncytial virus infection in cotton rats of different ages.[J] .Microb Pathog, 2019, 137: 0.
2. 单晓蕾,孙涛,于春荣,等.呼吸道合胞病毒感染的药效学动物模型研究进展[J].中国新药杂志,2017,26(06):631-634.
3. Fuentes, S., Klenow, L., Golding, H. et al. Preclinical evaluation of bacterially produced RSV-G protein vaccine: Strong protection against RSV challenge in cotton rat model. Sci Rep 7, 42428 (2017). https://doi.org/10.1038/srep42428
4. Zhu Q, McLellan JS, Kallewaard NL, et al. Highly potent extended half-life antibody as a potential RSV vaccine surrogate for all infants. Sci Transl Med 2017; 9: pii: eaaj1928
