【导读聚焦】
代谢重编程是生命活动与疾病发生的核心机制,肠道菌群代谢产物、膳食营养成分及神经-器官信号通路的交互作用,正逐步揭示疾病防治的全新靶点。近期发表于Nature, Nature metabolism, Advanced Science等顶刊的研究,从微生态、膳食代谢、神经调控等多个维度,解析了代谢分子在肿瘤、代谢性疾病、炎症等领域的关键作用,本期纳入了三篇果糖研究。
肠道菌群和代谢物展现出显著的促肿瘤/抗肿瘤干预潜力。卷曲乳酸杆菌分泌的芥酸可通过PPAR-δ通路诱导宫颈癌铁死亡,约氏乳杆菌则能合成鹅去氧胆酸降低高脂饮食诱导的结直肠癌风险;含糖饮料中的果糖与葡萄糖经SORD酶增强结直肠癌转移,而果糖还可通过调控癌症相关成纤维细胞与肿瘤细胞的交互驱动结直肠癌进展。
膳食成分的代谢机制解析为饮食-代谢性疾病的干预提供科学依据。适应膳食纤维的肠道菌群可清除膳食果糖、逆转肝脂肪变性;N-乳酰苯丙氨酸通过抑制AgRP神经元减少小鼠摄食;7-酮基脱氧胆酸作为天然TGR5激动剂,能通过内质网钙释放促进结肠黏膜愈合,为溃疡性结肠炎治疗提供新靶点;杏仁核-肝脏信号通路可独立于经典激素轴,协调应激状态下的血糖反应,为慢性应激相关代谢异常提供了全新的干预方向。
【导读目录】
-
Advanced Science | 卷曲乳酸杆菌来源的芥酸介导PPAR-𝜹通路诱导宫颈癌类器官铁死亡
-
Advanced Science | 7-酮基脱氧胆酸通过TGR5-IP3R通路诱导内质网钙释放促进结肠黏膜愈合
-
Nature Metabolism | N-乳酰苯丙氨酸(Lac-Phe)抑制AgRP神经元诱导小鼠摄食减少
-
Nature Metabolism | 含糖饮料中的果糖和葡萄糖通过山梨糖醇脱氢酶(SORD)增强结直肠癌转移
-
Cancer Research | 约氏乳杆菌合成鹅去氧胆酸以降低高脂饮食诱导结直肠癌的易感性
-
Nature Metabolism | 适应膳食纤维的肠道菌群能够清除膳食中的果糖并逆转肝脂肪变性
-
Gut | 果糖通过调控癌症相关成纤维细胞与肿瘤细胞间的交互作用驱动结直肠癌进展
-
Nature | 杏仁核-肝脏信号通路协调应激下的血糖反应
【资源领取】
本期导读文献原文,请在公众号后台回复“2025年10月绘谱导读”,即可获取资源链接。
【壹】
Advanced Science | 卷曲乳酸杆菌来源的芥酸介导PPAR-𝜹通路诱导宫颈癌类器官铁死亡

阴道微生物群在女性生殖健康中扮演重要角色,但其在宫颈癌发生发展中的具体作用机制尚不明确。本研究通过16S rRNA测序发现,宫颈癌患者阴道菌群中乳酸杆菌丰度显著降低,而卷曲乳酸杆菌(Lactobacillus crispatus)作为健康阴道状态的代表菌种,其代谢产物芥酸(Erucic Acid, EA)能够通过激活PPAR-δ信号通路,增强脂肪酸氧化(FAO),诱导大量活性氧(ROS)产生,最终引发宫颈癌类器官和细胞发生铁死亡。该研究首次揭示了卷曲乳酸杆菌来源的芥酸在宫颈癌治疗中的潜在作用,为宫颈癌的微生态治疗提供了新思路。
1.首先,为探究宫颈癌患者与健康女性阴道菌群的差异,研究采用16S rRNA测序分析了23例宫颈癌患者和89例健康女性的阴道分泌物。结果显示,宫颈癌患者阴道菌群中乳酸杆菌丰度显著降低,而普雷沃菌、消化链球菌等机会致病菌增多。进一步从健康女性中分离出卷曲乳酸杆菌(LC 001),并通过荧光染色确认其良好活性。作为验证,研究构建了来源于患者的宫颈癌类器官(PDO),并将其与无细胞上清液(CFS)共培养,发现CFS能显著抑制类器官活力和生长,而菌体本身无此效应。在宫颈癌细胞系(Ca Ski、C-33A)和细胞源性异种移植(CDX)模型中,CFS同样抑制了肿瘤增殖、迁移和侵袭,且该效应与pH值无关。
2.为解析CFS抑制肿瘤的机制,研究对CFS处理的类器官进行单细胞RNA测序。结果显示,CFS处理组中与细胞死亡抵抗相关的细胞比例下降,而铁死亡相关通路显著富集。进一步实验证实,CFS可诱导ROS积累和脂质过氧化,且该效应可被铁死亡抑制剂Ferrostatin-1逆转。随后通过非靶向代谢组学分析发现,芥酸在CFS中含量显著上升。体外实验表明,芥酸可抑制宫颈癌细胞增殖、迁移和侵袭,并诱导GSH耗竭、MDA和4-HNE积累等铁死亡特征。在CDX模型中,芥酸同样表现出显著的抑瘤效果。
3.最后,为阐明芥酸诱导铁死亡的信号通路,机制研究发现芥酸作为PPAR-δ的配体,激活下游脂肪酸氧化关键酶(如ACOX1、CPT2),促进NADH和乙酰辅酶A生成,增强ROS产生。使用PPAR-δ拮抗剂GSK3787可逆转芥酸诱导的ROS升高、铁死亡及肿瘤抑制效应,证实PPAR-δ-FAO-ROS通路在其中的核心作用。
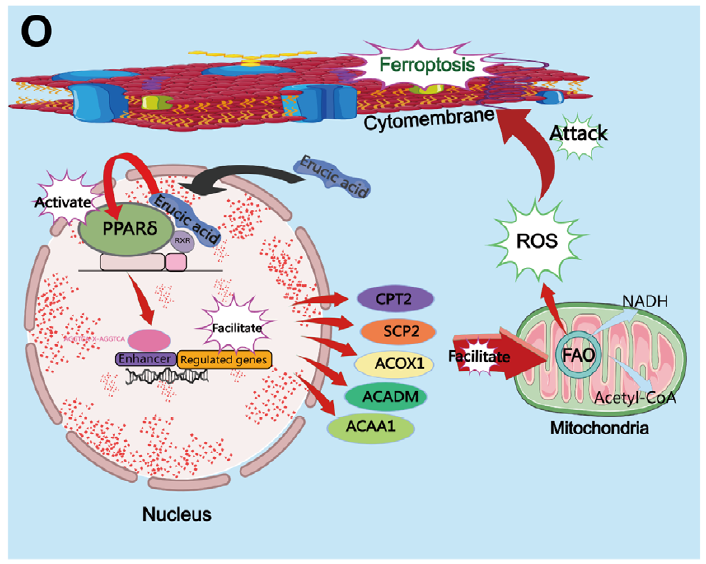
参考文献:Zhen Q, Xu Y, Xu Y, et al. Erucic Acid, Derived by Lactobacillus Crispatus, Induces Ferroptosis in Cervical Cancer Organoids Through the PPAR-δ Signaling Pathway. Adv Sci. 2025
【贰】
Advanced Science | 7-酮基脱氧胆酸通过TGR5-IP3R通路诱导内质网钙释放促进结肠黏膜愈合

溃疡性结肠炎(UC)的特征之一是结肠黏膜损伤后愈合障碍,而能够促进黏膜修复的内源性代谢物尚不明确。本研究发现,UC患者和结肠炎小鼠血清及结肠组织中7-酮基脱氧胆酸(7-KDCA)水平显著降低,且与疾病严重程度呈负相关,机制研究表明,7-KDCA通过激活TGR5受体,诱导内质网钙离子释放,促进肠上皮细胞迁移,从而加速黏膜愈合。该研究首次揭示了7-KDCA作为一种天然TGR5激动剂在结肠黏膜修复中的关键作用,为UC治疗提供了新靶点。
1.首先,研究采用LC-MS靶向代谢组学技术分析了UC患者和健康对照者的血清样本。结果显示,7-KDCA、脱氧胆酸(DCA)和石胆酸(LCA)水平在UC患者中显著降低,其中7-KDCA的降低与炎症指标(如CRP、ProCT)负相关,与白蛋白正相关,提示其与疾病严重程度密切相关。在DSS诱导的结肠炎小鼠模型中,这三种胆汁酸在急性期显著下降,恢复期回升,进一步验证了其与结肠病理变化的相关性。
2.为评估7-KDCA对黏膜修复的促进作用,研究在DSS诱导和活检损伤两种小鼠模型中口服补充7-KDCA。结果显示,7-KDCA能显著提高小鼠存活率、减轻体重下降、降低疾病活动指数、改善结肠长度和通透性,并上调紧密连接蛋白(如ZO-1、claudin-1)的表达。内镜和组织学分析进一步证实,7-KDCA治疗组黏膜溃疡和水肿明显减轻,愈合效果优于DCA和LCA。
3.体外划痕实验和Transwell迁移实验结果显示,7-KDCA能显著增强人结肠上皮细胞(NCM-460和HT-29)的迁移能力,而对细胞增殖影响不显著。通过siRNA敲低和药理学抑制实验发现,7-KDCA的促迁移和愈合作用依赖于TGR5受体,而非FXR受体。进一步机制研究表明,7-KDCA激活TGR5后,通过cAMP-PKA信号通路上调IP3水平,激活IP3受体,诱导内质网钙离子释放,从而驱动细胞迁移。
4.最后,研究通过AAV-shRNA在体敲低TGR5或IP3R,验证了7-KDCA的修复作用在TGR5或IP3R缺失小鼠中被完全阻断,而在FXR敲低小鼠中仍有效。此外,药代动力学分析显示,口服7-KDCA后其在肠道中浓度高而血中浓度极低,未引起全身性副作用(如胆囊充盈),表明其具有良好的肠道限制性和安全性。

参考文献:Zhang J, Jiang F, Xia W, et al. 7-Ketodeoxycholic Acid Promotes Colonic Mucosal Healing by Inducing Calcium Release from Endoplasmic Reticulum via the TGR5-IP3R Pathway. Adv Sci. 2025
【叁】
Nature Metabolism | N-乳酰苯丙氨酸(Lac-Phe)抑制AgRP神经元诱导小鼠摄食减少

N-乳酰苯丙氨酸(Lac-Phe)是一种乳酸盐衍生的循环代谢产物,是剧烈运动后血浆中最显著升高的代谢物,具有显著的抗肥胖作用,但Lac-Phe引起的摄食减少的机制仍不清楚。本文揭示了Lac-Phe介导代谢改善的分子和神经生物学机制,并指出这种运动诱导的代谢物可能对多种人类疾病中具有潜在治疗价值。
1.行为学与中枢作用验证:给小鼠腹腔或脑室内注射Lac-Phe,发现其能显著减少正常饮食和高脂饮食小鼠摄食行为。通过c-Fos 染色(神经元活动标志物)发现, Lac-Phe会激活小鼠脑干两个与食欲调控密切相关的神经元-孤束核(NTS)和下丘脑室旁核(PVH)。进一步用TRAP技术抑制激活的NTS神经元,发现抑制NTS神经元不影响Lac-Phe的厌食效应,而抑制激活的PVH神经元则厌食效应减弱。
2.神经环路与神经元作用研究:脑片电生理实验表明Lac-Phe不直接激活PVH神经元。通过狂犬病毒示踪,发现PVH神经元接受来自下丘脑弓状核(ARH)AgRP神经元的抑制性输入。利用电生理、钙成像、c-Fos检测等多种技术,证实Lac-Phe可直接抑制AgRP神经元活性。且该抑制需AgRP神经元参与,激活AgRP神经元会阻断Lac-Phe的摄食抑制作用。
3.分子机制探究:电生理实验显示Lac-Phe通过激活AgRP神经元上的ATP敏感性钾(KATP)通道抑制其活动,药理学阻断或利用CRISPR-Cas9敲除KATP通道均显著减弱Lac-Phe的摄食抑制作用,证实KATP通道是介导其神经抑制与代谢效应的关键分子。
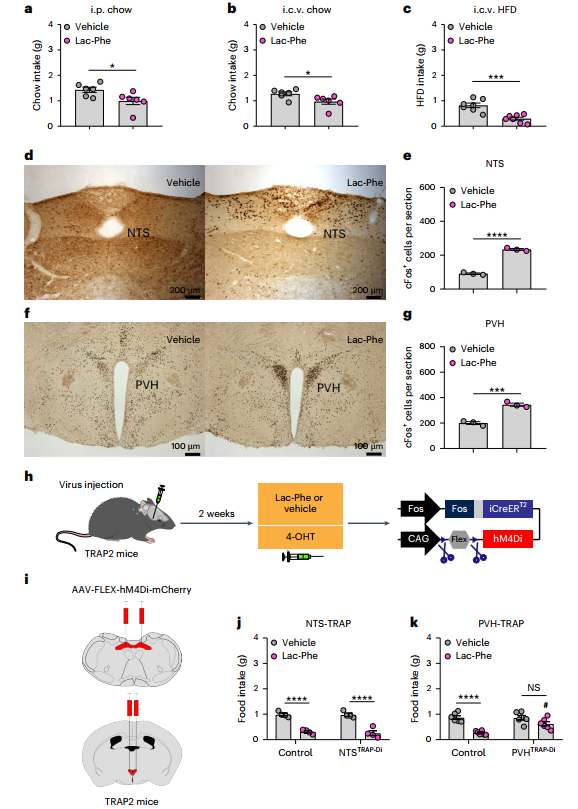
参考文献:Liu H, et al. Lac-Phe induces hypophagia by inhibiting AgRP neurons in mice. Nature Metabolism. 2025
【肆】
Nature Metabolism | 含糖饮料中的果糖和葡萄糖通过山梨糖醇脱氢酶(SORD)增强结直肠癌转移

含糖饮料(SSBs)含大量果糖与葡萄糖,已证实与结直肠癌(CRC)发病风险升高相关,但对CRC进展后期(如转移)的影响及机制尚不明确。全球SSB消费量持续上升,且年轻人群CRC发病率与死亡率上升,部分CRC患者确诊后仍饮用SSB。本研究旨在探究SSB中的果糖与葡萄糖是否促进晚期CRC转移,并揭示其分子机制,为CRC患者的饮食建议与治疗提供依据。
1.设置葡萄糖组、果糖组以及葡萄糖+果糖组(模拟SSB糖组成),评估其对CRC细胞生长、迁移和侵袭的影响。结果显示,葡萄糖+果糖组显著增强有迁移能力细胞系的迁移和侵袭。在CRC小鼠模型中,葡萄糖+果糖喂养组的肝转移灶数量显著增加。
2.代谢组学分析表明,葡萄糖+果糖组唯''一显著升高的代谢物为山梨糖醇。同位素标记实验证实,果糖可经SORD酶的逆向反应生成山梨糖醇,该过程消耗NADH并生成NAD+,葡萄糖则通过糖酵解提供NADH辅助该反应。SORD介导的逆向反应会导致细胞内的NAD+/NADH比值升高,从而会显著增强糖酵解和三羧酸循环的活性,进而激活甲羟戊酸通路,使用他汀类药物抑制甲羟戊酸通路可抑制癌细胞的迁移能力。
3.临床CRC组织样本中SORD表达高于正常组织,并且SORD的高表达主要集中在肿瘤上皮细胞,尤其是在那些具有干细胞特性的肿瘤细胞亚群中。CRISPR-Cas9敲除SORD显著降低CRC细胞的迁移与侵袭能力,而调控NAD+/NADH比值升高可恢复SORD敲除细胞的迁移能力。
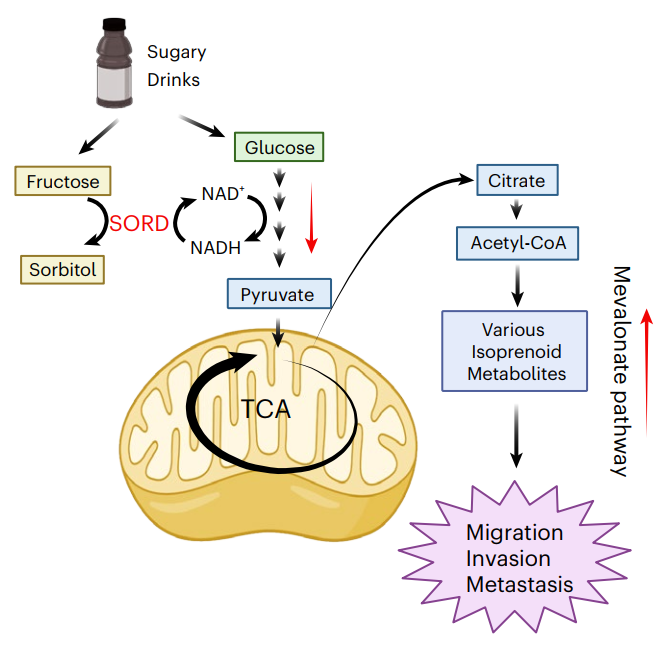
参考文献:Feng T, et al. Fructose and glucose from sugary drinks enhance colorectal cancer metastasis via SORD. Nature Metabolism. 2025
【伍】
Cancer Research | 约氏乳杆菌合成鹅去氧胆酸以降低高脂饮食诱导结直肠癌的易感性

高脂肪饮食(HFD)与结直肠癌(CRC)呈正相关,但不同个体对HFD引发的促肿瘤作用的敏感性存在显著差异。更深入理解调控高脂饮食效应的机制,有助于为结直肠癌的精准预防策略提供依据。本研究发现,L. johnsonii(约氏乳杆菌)的定植能够增加HFD暴露小鼠肠道中的熊去氧胆酸(CDCA)水平,揭示了“约氏乳杆菌-鹅去氧胆酸”这一益生菌干预通路,为减少高脂饮食诱导的结直肠癌进展提供了潜在途径。
1.对HIC-R(对结直肠癌具有抵抗力)和HIC-S(结直肠癌易感)小鼠的粪便样本进行16S rRNA测序,结果发现,两组小鼠的肠道菌群存在显著差异。HIC-R小鼠肠道中乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)等潜在益生菌丰度显著升高,特别是约氏乳杆菌(Lactobacillus johnsonii)的富集尤为突出。
2.通过非靶向代谢组学分析初步发现,胆汁酸分泌和生物合成通路显著富集。进一步通过靶向代谢组学发现,胆汁酸谱发生了显著变化,肠道中CDCA的含量显著增加。进一步给予L. johnsonii灌胃处理,显著提高了模型小鼠粪便CDCA水平。约氏乳杆菌通过小鼠肠道中CDCA水平,进一步减少肿瘤数量和体积、抑制肿瘤生长和降低其异常增生。
3.对CDCA刺激后的肿瘤细胞团进行了RNA-Seq分析,结果发现,与线粒体翻译和呼吸电子传递链径相关的基因出现了显著下调。
4.L. johnsonii通过胆盐水解酶(BSH)将结合胆酸转化为CDCA,并且CDCA诱导线粒体功能障碍和氧化应激,从而促进细胞凋亡,有效地抑制肿瘤的发展。
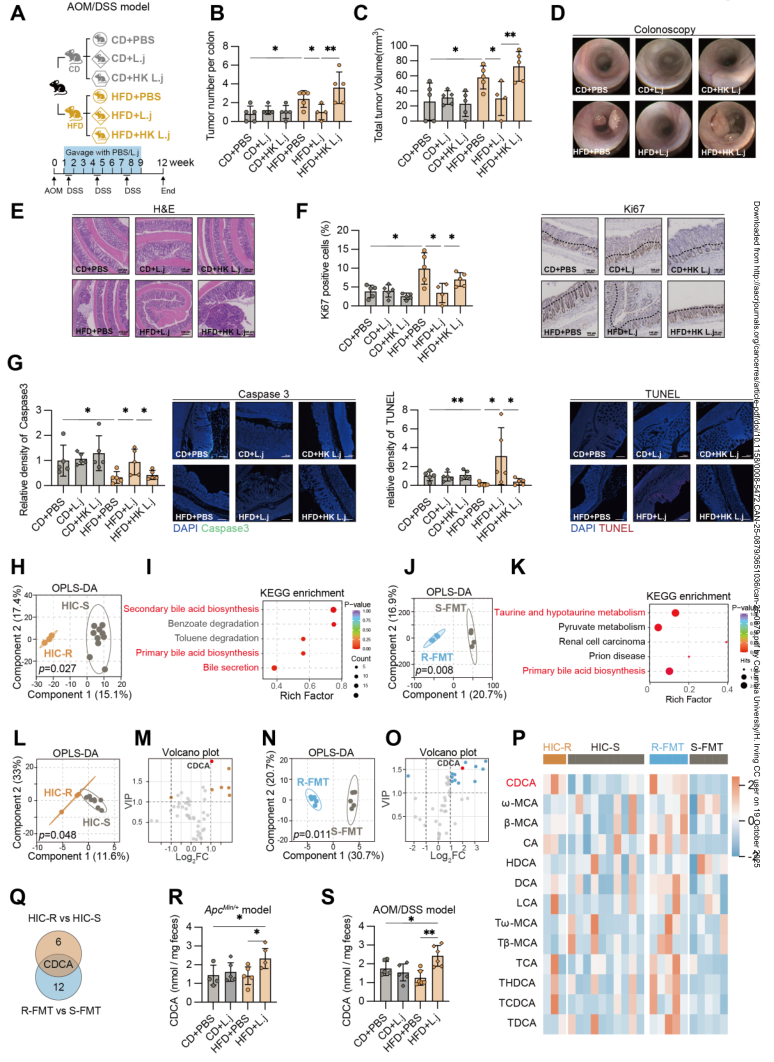
参考文献:Liu C, Lai P, Hu J, et al. Lactobacillus johnsonii Synthesizes Chenodeoxycholic Acid to Reduce Susceptibility to High-Fat Diet-Induced Colorectal Cancer. Cancer Research. 2025
【陆】
Nature Metabolism | 适应膳食纤维的肠道菌群能够清除膳食中的果糖并逆转肝脂肪变性

过量摄入单糖果糖可导致肝脏脂肪生成过度以及肠道菌群失调,是引发心血管代谢疾病的一个风险因素。本研究发现,当肠道菌群适应膳食纤维菊粉时,会分解饮食中的果糖,并减轻或逆转胰岛素抵抗、肝脏脂肪变性和纤维化。菊粉还能激活肝脏的新生丝氨酸合成和胱氨酸摄取,增加谷胱甘肽的生成,保护肝脏免受果糖引起的脂质过氧化。这些分析为膳食纤维如何能够促进肠道微生物群发挥作用、从而减轻宿主对有害营养物质的摄入以及减缓疾病进展提供了机制解释。
1.肝脏脂质组学分析表明,补充菊粉减少了肝脏的脂质种类,包括鞘氨醇、鞘磷脂、二酰甘油和三酰甘油。qPCR分析表明,同时或延迟补充菊粉会下调由高果糖玉米糖浆诱导的肝脏纤维化标志物的基因表达。
2.通过氘代水(2H2O)示踪探究了同步与延迟补充菊粉对肝脏DNL(新生脂肪生成)的影响,结果发现,小鼠单独喂食高果糖玉米糖浆(HFCS) 14周后,2H标记的脂肪酸显著增加,而同步或延迟补充菊粉均能抑制或逆转这种诱导效应。
3.通过13C-果糖同位素示踪技术分析发现,菊粉组小鼠肝脏线粒体中13C标记酰基肉碱水平升高。进一步结合代谢组学分析发现,喂食果糖和菊粉的实验鼠盲肠中果糖衍生的短链脂肪酸的生成减少了,但在小肠内容物中乙酸与丁'酸生成显著增加,提示菊粉可调节肠道不同部位的果糖代谢途径。
4.通过给小鼠喂养13C-果糖并基于肝脏代谢组学分析发现,HFCS加菊粉饮食的小鼠肝脏中,由果糖合成的甘氨酸和丝氨酸比例显著增加。
5.通过16S rRNA测序分析发现,菊粉补充使大肠中的产酸拟杆菌(B. acidifaciens)显著富集,且产酸拟杆菌与肝脏DNL呈显著负相关,与肝脏丝氨酸合成呈显著正相关。
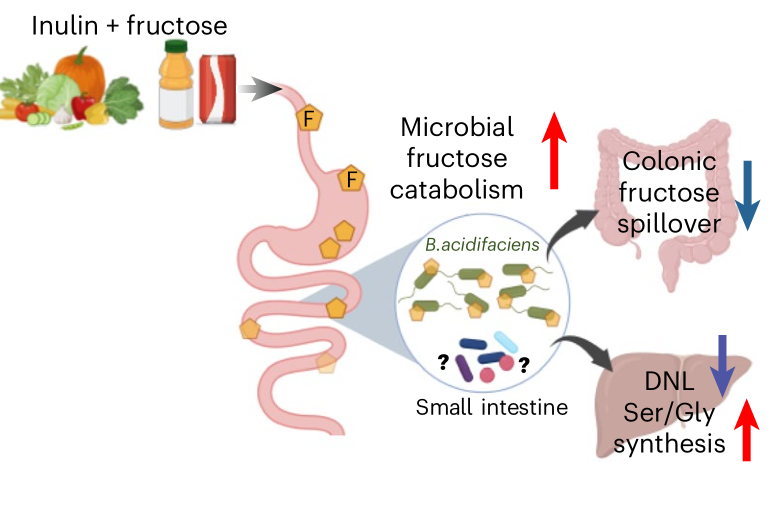
参考文献:Jung S, Bae H, Song WS, et al. Dietary fibre-adapted gut microbiome clears dietary fructose and reverses hepatic steatosis. Nature Metabolism. 2025
【柒】
Gut | 果糖通过调控癌症相关成纤维细胞与肿瘤细胞间的交互作用驱动结直肠癌进展

结直肠癌(CRC)发病率持续上升,肿瘤微环境(TME)中的癌症相关成纤维细胞(CAFs)通过分泌细胞因子与代谢重编程,与癌细胞形成“共生回路”,肿瘤增殖、侵袭和耐药。果糖作为膳食单糖,其转运体GLUT5(SLC2A5)在多种癌细胞中异常高表达,可直接驱动肿瘤恶性表型,但果糖是否同样被CAFs利用并介导肿瘤-基质互作仍空白。本研究整合473例CRC临床标本、单细胞测序、代谢示踪及多种基因工程小鼠模型,系统解析果糖在CAFs中的代谢命运及其对肿瘤-基质通讯的调控作用。
1.CAFs表达GLUT5,其水平与肿瘤浸润深度、TNM分期及患者不良预后正相关;在多癌种中亦观察到GLUT5+CAFs,提示该现象具有普遍性。
2.果糖可直接被CAFs摄取,经氧化磷酸化生成ATP,增强其增殖、迁移及激活标志物α-SMA/FSP-1表达;抑制GLUT5或果糖代谢酶KHK可逆转上述效应。
3.肿瘤细胞利用果糖后释放核苷酸及氨基酸(组氨酸、赖氨酸等),这些代谢物通过激活CAFs的Erk信号通路上调CXCL14表达;阻断代谢物转运或Erk磷酸化均可抑制CXCL14升高。
4.CXCL14+CAFs通过ACKR2/CXCR4受体反向激活肿瘤细胞的Erk通路,促进上皮-间质转化EMT、迁移和远处转移;敲低CAFs中CXCL14或肿瘤细胞中其受体均显著削弱果糖诱导的转移能力。
5.小鼠模型显示,高果糖饮食或GLUT5过表达加速原位瘤生长和肺转移,而GLUT5敲除或CXCL14抑制可抵消果糖促瘤效应,证实果糖-CXCL14轴是治疗潜在靶点。
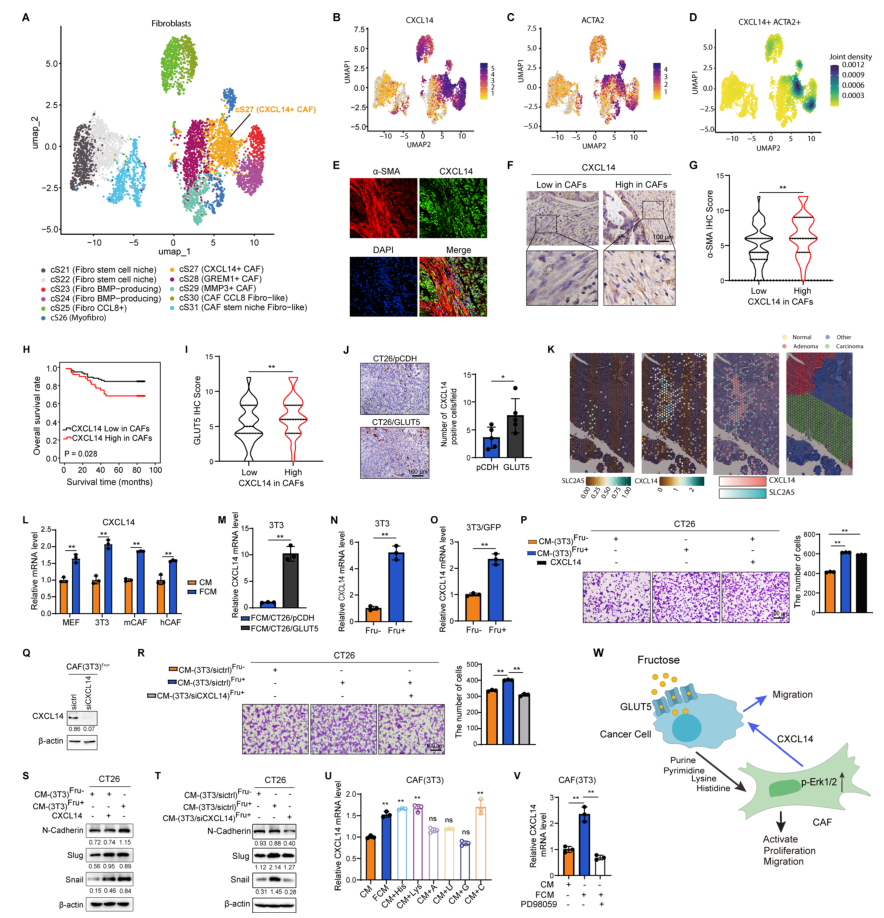
参考文献:Cui, Y., Liu, H., Zhang, L., et al. Fructose drives colorectal cancer progression by regulating crosstalk between cancer-associated fibroblasts and tumour cells. Gut. 2025
【捌】
Nature | 杏仁核-肝脏信号通路协调应激下的血糖反应

在遭遇威胁时,生物体需在数分钟内动员能量,表现为血糖升高和食欲抑制,传统观点将此归因为下丘脑-垂体-肾上腺轴及肾上'腺素的快速分泌。然而,临床研究发现慢性应激人群即使激素水平正常,仍易出现糖耐量受损和2型糖尿病,提示存在未被阐明的脑-肝直接通路。内侧杏仁核(MeA)是情绪与威胁感知的核心,其下游密集投射至调控代谢的腹内侧下丘脑(VMH),但MeA是否可独立于经典内分泌轴、直接指挥肝脏糖异生仍未知。本研究结合化学遗传、光遗传、病毒跨突触追踪及13C示踪技术,系统解析MeA-VMH-肝脏环路在急性与反复应激中的血糖调控作用。
1.各类急性应激(束缚、社交、电击、视觉)均迅速激活MeA神经元,其钙信号峰值早于血糖上升,提示MeA是应激性高血糖的“启动器”。
2.特异性激活MeA→VMH谷氨酸或GABA神经元可在15分钟内使血糖升高20–40mg/dL,同时抑制进食,而血浆皮质酮、胰岛素、胰高血糖素和肾上'腺素水平无变化,证明该通路独立于经典激素轴。
3.病毒示踪显示MeA经VMH→交感神经→腹腔神经节形成多突触通路直抵肝脏;激活MeAVMH神经元显著提高肝脏糖异生限速酶G6pc和转录因子FOXO1的表达,13C-丙酮酸示踪证实肝脏M2-葡萄糖、M2-柠檬酸等中间产物增加30–50%,说明糖异生通量增强。
4.抑制或敲除MeA-VMH神经元可完全阻断急性应激诱导的高血糖,却不影响基础血糖、糖耐量及应激激素水平,进一步确立该环路的“专职”应激血糖角色。
5.反复应激使MeA与MeAVMH神经元钙反应逐次衰减,血糖升高幅度下降;慢性沉默或消融MeAVMH的小鼠在高脂饮食下表现出持续高血糖、糖耐量受损和肝G6pc上调,重现人类应激相关代谢异常的早期表型。
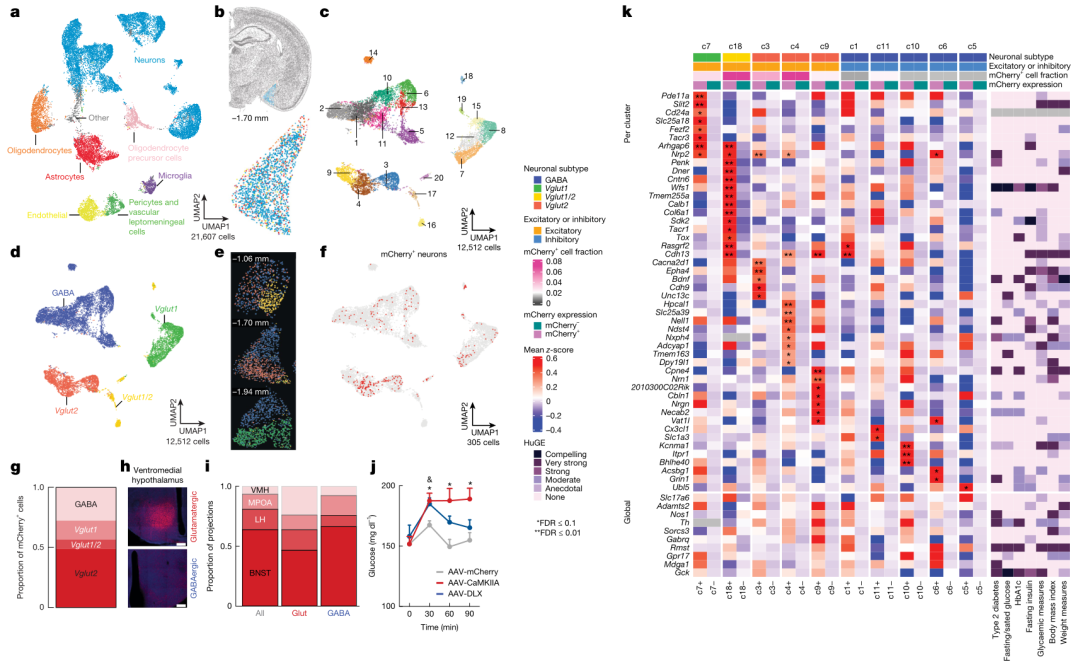
参考文献:Carty, J. R. E., Devarakonda, K., O’Connor, R. M., et al. (2025). Amygdala–liver signaling orchestrates glycaemic responses to stress. Nature. 2025
