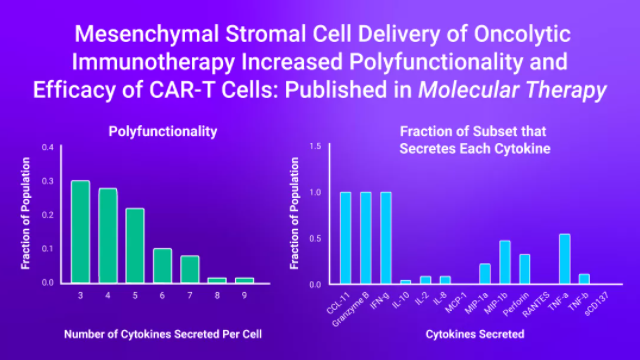
��� IsoPlexis单细胞蛋白组学检测技术证明了,利用表达IL-12和PD-L1阻断蛋白的组合基因工程腺病毒感染间充质干细胞(CAd12_PD-L1 MSCs)促进了HER.2-CAR-T细胞的肿瘤抗原特异性多功能性,并且该多功能性与CAR-T细胞在体外和体内抗肿瘤活性增强相关。
��� 单细胞多重蛋白组学技术也揭示了HER.2 CAR-T细胞的多功能性增加对肿瘤抗原的反应增强,CAd12_PD-L1骨髓间充质干细胞治疗组中有34%的CD4+和40%的CD8+CAR-T多功能性细胞,而HER.2 CAR-T单一治疗组中仅有5%的CD4+和16%的CD8+CAR-T多功能性细胞。
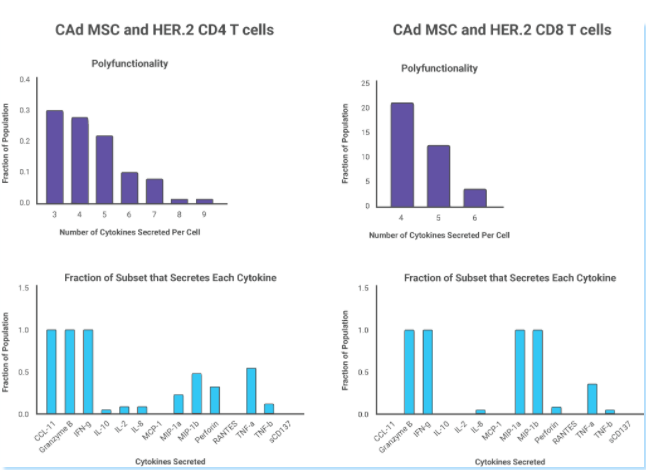
��� 当肿瘤细胞和CAd12_PD-L1间充质干细胞MSC载体共培养时,多功能CD4+HER.2 CAR-T细胞显示出共同分泌IFN-g、颗粒酶B和CCL11的大多数细胞因子的特征,而多功能CD8-HER.2 CAR-T细胞与IFN-g、颗粒酶B、TNF-a和穿孔素共同分泌具有更大的细胞溶解活性,这解释了CAd12_PD-L1 MSCs提高体内HER.2 CAR-T细胞抗肿瘤活性相关机制。
��� IsoPlexis单细胞功能蛋白质组学技术为CAd12_PD-L1 MSC在增强HER.2 CAR-T细胞多功能性和效应细胞因子方面提供了独特的机制见解,并证明了溶瘤免疫疗法与CAR-T细胞疗法的联合治疗在促进抗肿瘤功能方面的方法学和效果。
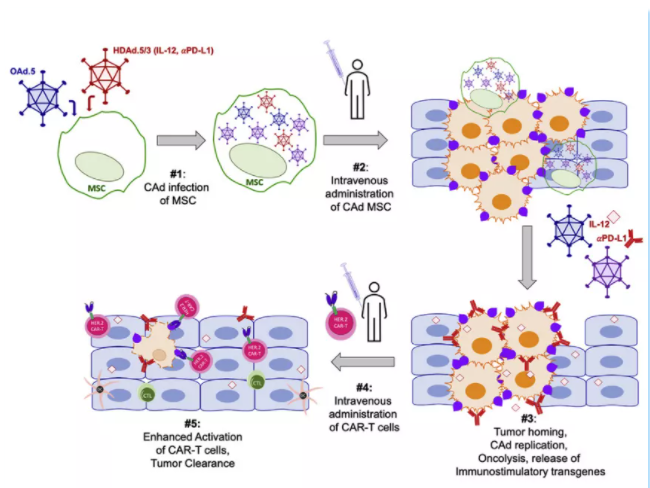
肿瘤微环境 (TME) 的复杂性可以限制CAR-T细胞的浸润,并为使用过继细胞疗法治疗实体瘤设置障碍。TME会产生免疫抑制蛋白、细胞因子和趋化因子,从而抑制细胞毒性T细胞反应。因此,确认可破坏TME同时促进T细胞持久性功能驱动因素的疗法是实体瘤治疗的一个重要目标。基于工程化腺病毒 (OAd) 的溶瘤免疫疗法可破坏TME并刺激相关CAR-T细胞,增强宿主抗肿瘤免疫反应。但是溶瘤病毒如何递送到相应病灶内的肿瘤部位极具挑战性,而且由于患者对病毒治疗的天然或适应性免疫反应,在某些情况下无法进行静脉给药。为了克服这些挑战,利用特定细胞载体系统如间充质干细胞 (MSC) 可将OAd递送至肿瘤部位。最近发表在Molecular Therapy上的一项研究通过IsoPlexis的单细胞蛋白质组学技术证实了OAd细胞递送联合CAR-T疗法在治疗实体瘤方面的方法学及效果。
利用功能性单细胞蛋白质组学技术解决溶瘤免疫疗法破坏肿瘤微环境的挑战
McKenna等科学家在研究中使用间充质干细胞(MSCs)系统的递送包含OAd和辅助性腺病毒(HDAd) 并表达白介素-12(IL-12)和PD-L1(程序性死亡配体1)阻断蛋白的组合载体[CAd]。CAd感染的MSCs可以递送并释放有功能的病毒感染和裂解肺肿瘤细胞,同时通过释放IL-12和PD-L1阻断蛋白增强CAR-T细胞抗肿瘤活性。这种方法与靶向HER2特异性CAR-T细胞疗法的结合可在体外消除3D培养的肿瘤球体,并且在体内观察到抑制了两种原位肺癌模型的肿瘤生长。与单一CAR-T细胞治疗相比,组合载体CAd通过间充质干细胞MSCs递送疗法增加了人T细胞的总体数量,并增强了其多功能细胞因子的分泌。
单细胞分泌蛋白质组学鉴定与CAd感染的骨髓间充质干细胞治疗的CAR-T细胞抗肿瘤功能改善相关的上调T细胞多功能性
研究中也提到IsoPlexis的功能蛋白质组学技术来分析CAd感染的MSC提高HER.2 CAR-T细胞功效的机制。单细胞分泌组芯片用于测量单个CAR-T细胞的多功能性。在以前的研究中,多功能性与抗肿瘤活性有关,并可以很好预测临床结果。IsoPlexis单细胞分泌蛋白质组学技术发现CAd-MSC与肿瘤细胞系共培养的HER2 CAR-T细胞相比未经CAd-MSC共同培养的CAR-T细胞具有更多的多功能性T细胞(分别占CD4+和CD8+细胞的34%和40% VS 5%和16%)。
联合治疗通过增加CAR-T细胞中多功能细胞的数量有效地增强了HER.2 CAR-T细胞的抗肿瘤活性。
在IsoSpeak软件对相关细胞亚群进行进一步分析中发现,与未感染Ad的MSCs共培养的一部分CD4+细胞主要分泌IL-8,而与CAd MSCs共培养的一个CD4+细胞亚群中细胞分泌多达9种细胞因子,其中大部分同时分泌IFN-g、Granzyme B和CCL11。CAd MSCs促进了CD4+CAR-T细胞对肿瘤细胞的促炎细胞因子的产生。在CD8+CAR-T细胞亚群中则发现CD8+HER.2 CAR-T细胞分泌相关效应因子的增多,包含INF-g,Granzyme B,MIP-a等。经CAd MSCs处理的CD4+和CD8+CAR-T细胞均显示CCL11的分泌增多(CCL11是一种与粘附分子和T细胞趋化性增加相关的趋化因子)。IsoPlexis功能性单细胞蛋白质组学技术揭示了CAd MSCs增强CAR-T细胞功效的抗肿瘤活性相关机制。
这种抗肿瘤活性在随后的小鼠肺癌模型中的实验结果一致,利用IsoPlexis技术可以在更短的时间内利用体外3D细胞培养模型提供与体内生物学反应相一致的结果和见解。CAd-MSCs治疗联合HER.2 CAR-T治疗与单独CAR-T治疗相比,能够显著抑制肿瘤生长。肺部肿瘤内T细胞数据显示,与单一CAR-T治疗组相比,CAd-MSC联合CAR-T治疗细胞组中CD8+T细胞的耗竭标志物Tim3的表达降低,表明CAd-MSC促进了T细胞的持久性。使用异种移植肺肿瘤模型进行的小鼠体内研究得出的结果与3D培养细胞中结果相一致:联合治疗实现肿瘤在2周内完全清除,且未观察到任何负面作用。
总结McKenna等人的研究结果揭示了CAd-MSCs和CAR-T独特的联合疗法的抗肿瘤活性内在机制。联合治疗可破坏TME,改善T细胞浸润,增强T细胞的多功能性,而多功能性与抗肿瘤活性相关。IsoPlexis通过IsoCode单细胞分泌蛋白组芯片
地 址: 暂无 联系人: 苗先生 电 话: 4001118515 传 真: 暂无 Email:Info.apac@isoplexis.com
IsoPlexis
商家主页
